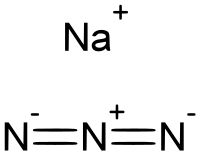Azida de sódio
Azida de sódio, azida sódica, azeto de sódio, azoteto de sódio [PT], trinitrogeneto de sódio ou trinitreto de sódio, é o composto químico com fórmula NaN3. Este sal incolor é um reagente comum em síntese orgânica, e é um componente em muitos sistemas de "airbag" em veículos.
Estrutura, síntese e principais reações
Estrutura
Azida de sódio é um composto iônico. O grupo N3- é centrosimétrico com as distâncias N-N de 1.18 Å. Azida de sódio é altamente solúvel em água. Tais soluções contém mínimas quantidades de azida de hidrogênio, como descrito pelo seguinte equilíbrio:
-
N3− + H2O
HN3 + OH− K = 10−4.6
Preparação
O método comum de síntese é o processo Wislicenus, o qual se dá em duas etapas, partindo da amônia. Na primeira etapa, a amônia é convertida em amida de sódio:
- 2 Na + 2 NH3 → 2 NaNH2 + H2
A amida de sódio é, então, combinada com óxido nitroso.
- 2 NaNH2 + N2O → NaN3 + NaOH + NH3
Alternativamente, o sal pode ser obtido pela reação de nitrato de sódio com amida de sódio.
Reações
Tratamento da azida de sódio com ácidos fortes resulta o ácido correspondente, ácido hidrazóico:
- H2SO4 + NaN3 → HN3 + NaHSO4
Azida de sódio não pode ser fundida, mas decompõe-se vigorosamente a sódio metálico e gás nitrogênio a aproximadamente 300 °C. Este comportamento é aproveitado quando uma carga elétrica disparada por impacto de automóveis aquece o sal e explosivamente libera nitrogênio expandindo o airbag:
- 2 NaN3 → 2 Na + 3 N2
O sódio metálico que é formado apresenta perigo, por isso, em airbags de automóveis, ele é convertido por reação com outros reagentes, tais como o nitrato de potássio (KNO3) e sílica (SiO2), em um inerte "vidro" de silicato alcalino.
Azida de sódio é usada em síntese orgãnica para introduzir o grupo funcional azida por eliminação de um haleto. O grupo funcional azida pode posteriormente ser convertido a uma amina por redução com hidreto de lítio e alumínio, ou uma fosfina terciária tal como trifenilfosfine na reação de Staudinger.
Azida de sódio pode ser destruído por tratamento com solução ácida de nitrito de sódio:
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
Bioquímica e usos biomédicos
Azida de sódio é um útil reagente de prova, mutagênico, e preservativo. Em hospitais e laboratórios, é um biocida; e é especialmente importante em reagentes em escala soluções estoque os quais devem sustentar crescimento bacterial onde a azida de sódio atua como um bacteriostático por inibir a citocromo oxidase em bactérias gram-negativas; gram-positivos (estreptococos, pneumococos, lactobacilos) são resistentes (uma característica similar a resistência a antibiótico). Isto pode ser usado em agrucultura para controle de pragas.
Azida inibe citocromo oxidase por ligar-se irreversivelmente ao cofator heme em um processo similar à ação do monóxido de carbono. Azida de sódio particularmente afeta órgãos que apresentam altas taxas de respiração, tal como o coração e o cérebro.
Ligações externas
- «International Chemical Safety Card 0950» .
- «NIOSH Pocket Guide to Chemical Hazards» .
- «European Chemicals Bureau» .
- «Scientific American Ask the Experts» .
- «External MSDS Data Sheet» .
- «Straight Dope on Sodium Azide»