Anilina
Anilina, fenilamina ou aminobenzeno é um composto orgânico, líquido, incolor e ligeiramente amarelo de odor característico e um sabor aromático cáustico, que se obtém a partir do nitrobenzol. Não se evapora facilmente à temperatura ambiente, sendo facilmente inflamável, queimando com uma chama fumacenta. A anilina é solúvel no éter e no álcool, bem como na maioria dos solventes orgânicos e inorgânicos.
Com a anilina confeccionam-se os mais variegados corantes, desde o azul de metileno, passando pela fucsina, pela eosina, pelo vermelho-do-congo e pelo violeta-de-genciana, entre outros.
Aplicações
A anilina é usada para fabricar uma ampla variedade produtos como por exemplo a espuma de poliuretano, produtos químicos agrícolas, pinturas sintéticas, antioxidantes, estabilizadores para a indústria do látex, herbicidas e vernizes e explosivos e também na fabricação de preservativos masculinos e femininos.
É usada, entre diversas outras funções, como matéria prima para inúmeros corantes, advindo daí, exatamente, o uso até errôneo deste termo como sinônimo de corante.
Estrutura e síntese
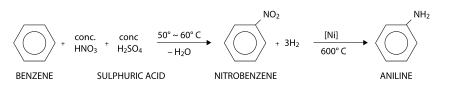
Consistindo de um grupo fenila ligado a um grupo amino, a anilina é normalmente produzida industrialmente em dois passos do benzeno:
Primeiro, benzeno é nitrado usando uma mistura concentrada de ácido nítrico e ácido sulfúrico a 50 a 60 °C, o qual resulta em nitrobenzeno. No segundo passo, o nitrobenzeno é hidrogenado, tipicamente a 600 °C em presença de um catalisador de níquel para resultando na anilina. Como alternativa, anilina é também preparada do fenol e amônia, o fenol sendo derivado do cumeno.
Derivados
Muitos derivados de anilina podem ser preparados de maneira similar. No comércio, três tipos de anilina são distinguidas - óleo de anilina para azul, o qual é anilina tecnicamente pura; óleo de anilina para vermelho, uma mistura de quantidades equimolares de anilina e orto- e para-toluidina; e óleo de anilina para safranina, a qual contém anilina e orto-toluidina, e é obtida pela destilação da fusão (escórias) da fucsina.
Propriedades
Oxidação
Anilina é incolor, ela lentamente oxida-se ao ar, resultando numa coloração castanho-avermelhada em amostras envelhecidas. A oxidação da anilina tem sido cuidadosamente investigada. Em solução alcalina, azobenzeno resulta, enquanto ácido arsênico produz a coloração violeta da chamada violanilina. Ácido crômico a converte em quinona, enquanto cloratos, na presença de certos sais metálicos, especialmente do vanádio), dando negro de anilina. Ácido clorídrico e clorato de potássio dão cloranil. Permanganato de potássio em solução neutra oxida-a em nitrobenzeno, em solução alcalina a azobenzeno, amônia e ácido oxálico, em solução ácida a negro de anilina. Ácido hipocloroso dá 4-aminofenol e para-amino-difenilamina.
Basicidade
Anilina é uma base fraca. Aminas aromáticas tais como a anilina são, em geral, bases muito mais fracas que aminas alifáticas. Anilina reage com ácidos fortes formando íon anilinium (ou anilínio, fenilamonium, fenilamônio) (C6H5-NH3+). O sulfato forma cristais em forma de belas placas brancas. Embora anilina seja fracamente básica, ela precipita sais de zinco, alumínio, e sais férricos, e, sob aquecimento, expele amônia de seus sais. A fraca basicidade é devido a um efeito indutivo negativo como o par solitário de elétrons no nitrogênio ser parcialmente deslocalizado no sistema pi do anel benzênico.
Acilação
Anilina reage com ácidos carboxílicos ou mais facilmente com cloretos de acila tais como cloreto de acetila resultando em amidas. As amidas formadas de anilina são algumas vezes chamadas anilidas, por exemplo CH3-CO-NH-C6H5 é chamada de acetanilida. Antifebrina (acetanilida), um antipirético e analgésico, é obtido pela reação de ácido acético e anilina.
Derivados de N-alquila
Anilina combina-se diretamente com iodetos de alquila para formar aminas secundárias e terciárias. Metil e dimetilanilina são líquidos incolores preparados por aquecimento de anilina, cloridrato de anilina e metanol em um autoclave a 220 °C. Elas são de grande importância na indústria de corantes, assim como também, na produção de corantes específicos, a N,N-dietilanilina. Metilanilina ebule a 193-195 °C, dimetilanilina a 192 °C.
Derivados de enxofre
Por ebulição com dissulfeto de carbono, dá sulfocarbanilida (difenil tioureia), CS(NHC6H5)2, a qual pode ser decomposta em fenil isotiocianato, C6H5CNS, e trifenil guanidina, C6H5N=C(NHC6H5)2.
Como fenóis, derivados de anilina são altamente suscetíveis a reações de substituição eletrofílica. Por exemplo, a reação de anilina com ácido sulfúrico a 180 °C produz ácido sulfanílico, NH2C6H4SO3H, o qual pode ser convertido a sulfanilamida. Sulfanilamida é uma das sulfonamidas ou "sulfas" que foram largamente usadas como antibacterianos no início do século XX.
Diazotização
Por meio da diazotização ou reações de transferência de grupo diazo, a anilina e seus derivados substituídos no anel reagem com ácido nitroso formando sais de diazônio. Através deles, o grupo -NH2 da anilina pode ser convenientemente convertido a -OH, -CN, ou um haleto via a as reações de Sandmeyer. É uma importante reação na produção de compostos chamados azo-compostos, incluindo muitos corantes, por sua vez, chamados corantes azóicos.
Outras reações
Anilina reage com nitrobenzeno produzindo fenazina na reação de Wohl-Aue.
Seu acetato é usado no teste do acetato de anilina para carboidratos, identificando pentoses por conversão a furfural.
Toxicologia
A DL50 em ratos é de 440 mg/kg. Tem absorção tanto dérmica, como oral e pulmonar.