
Acetato de cálcio
| Acetato de cálcio Alerta sobre risco à saúde | |
|---|---|

| |
| |
| Nome IUPAC | Acetato de cálcio |
| Identificadores | |
| Abreviação | Ca(OAc)2 |
| Número CAS | 62-54-4 |
| ChemSpider | 5890 |
| SMILES |
|
| InChI |
1/2C2H4O2.Ca/c2*1-2(3)4;/h2*1H3,(H,3,4);/q;;+2/p-2
|
| Propriedades | |
| Fórmula química | C4H6CaO4 |
| Massa molar | 158.14 g mol-1 |
| Aparência | Sólido branco higroscopico |
| Densidade | 1.6 g/cm3 |
| Ponto de fusão |
160 °C |
| Solubilidade em água | 37.4 g/100 mL (0 °C) 34.7 g/100 mL (20 °C) 29.7 g/100 mL (100 °C) |
| Solubilidade | Parcialmente solúvel em metanol insolúvel em acetona, etanol e benzeno |
| Acidez (pKa) | 6.3-9.6 |
| Farmacologia | |
| Riscos associados | |
| NFPA 704 | |
|
Temperatura de auto-ignição |
680 - 730 °C |
| LD50 | 4280 mg/kg (oral, rat) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
|
Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
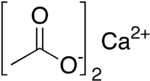
O acetato de cálcio é um sal de cálcio do ácido acético. Com a fórmula Ca(C2H3O2)2, o seu nome comercial é acetato de cálcio, enquanto etanoato de cálcio é o nome sistemático da IUPAC. Um antigo nome é acetato de cal. A forma anidra é muito higroscópica, por isso a forma monoidratada (Ca(CH3COO)2 • H2O, número CAS [5743-26-0]) é a mais comum.
Produção
O acetato de cálcio pode ser preparado pela reação entre carbonato de cálcio (encontrado em cascas de ovos, ou em rochas carbonáticas como o calcário e mármore ) ou cal hidratada com ácido acético:
- CaCO3 (s) + 2 CH3COOH (aq) → Ca(CH3COO)2 (aq) + H2O (l) + CO2 (g)
- Ca(OH)2 (s) + 2 CH3COOH (aq) → Ca(CH3COO)2 (aq) + 2 H2O (l)
Reações
Se um álcool é adicionado a uma solução saturada de acetato de cálcio, forma-se um gel semissólido inflamável. Se ao acetato de cálcio for adicionado etanol, o gel resultante terá cor esbranquiçada, com as características físicas de uma bola de neve.
Aplicações
Em doenças renais, os níveis de fosfato no sangue podem subir (chamado hiperfosfatemia), originando problemas ósseos. O acetato de cálcio é usado para reduzir os níveis de fosfato do sangue, porém este tratamento pode ocasionar efeitos colaterais como a dor de estômago.
Acetato de cálcio é ainda usado como aditivo alimentar, estabilizador e sequestrante, principalmente em produtos doces. Além disso, ele neutraliza o flúor na água.
História
Por ser barato, o acetato de cálcio foi usado como material de partida para a síntese de acetona antes do desenvolvimento do processo de cumeno.
O acetato de cálcio pode ser preparado através da imersão de carbonato de cálcio (encontrado em cascas de ovos, ou em rochas carbonáceas comuns, tais como calcário ou mármore) em vinagre. Uma vez que ambos os reagentes teriam sido disponíveis pré-historicamente, então o produto químico teria sido observado como cristais.

